Il faut administrer la dose omise de LEQVIOMD dès que possible et maintenir le calendrier d’administration initial.
Un nouveau calendrier d’administration doit être commencé.
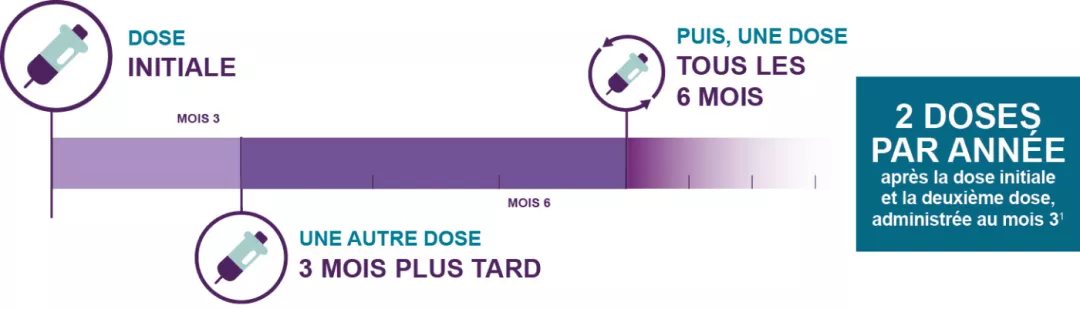
Une première dose de LEQVIOMD doit être administrée le plus tôt possible, suivie d’une deuxième dose trois mois plus tard, puis d’une dose tous les six mois par la suite.
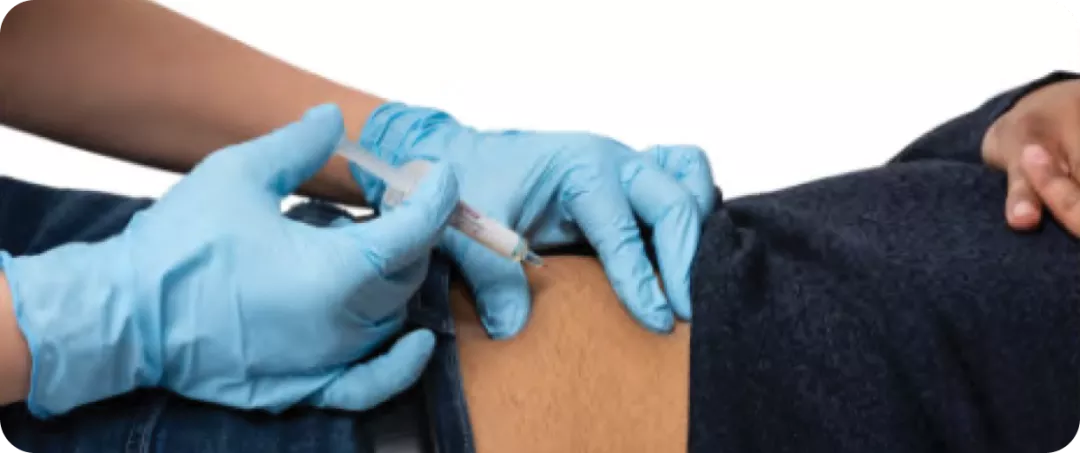
Injection sous-cutanée unique par dose.
Jeter après une seule utilisation.
Jeter la seringue et l’aiguille dans un contenant pour objets pointus ou tranchants homologué1.
Hypercholestérolémie non familiale avec maladie cardiovasculaire athéroscléreuse (MCVA); ou
Hypercholestérolémie familiale hétérozygote (HFHe).
comme traitement d’appoint au régime alimentaire et au traitement par une statine, seul ou en association avec d’autres traitements hypolipidémiants, chez les patients qui ont besoin d’une réduction additionnelle de leur taux de C-LDL;
comme traitement d’appoint au régime alimentaire, seul ou en association avec d’autres traitements hypolipidémiants qu’une statine, chez les patients pour qui les statines sont contre-indiquées.
comme traitement d’appoint au régime alimentaire et aux statines, avec ou sans autres traitements hypolipémiants;
comme traitement d’appoint au régime alimentaire, en monothérapie ou en association avec d’autres agents modifiant les lipides qui ne sont pas des statines, lorsque l’emploi d’une statine est contre‐indiqué.
LEQVIOMDest administré par un professionnel de la santé à raison de deux doses par année
Schéma posologique
Renseignements supplémentaires à propos de l’administration
Dose oubliée
Dans le cas d’un retard dans l’administration de LEQVIOMD de 1:
< 3 mois | ≥ 3 mois |
|---|---|
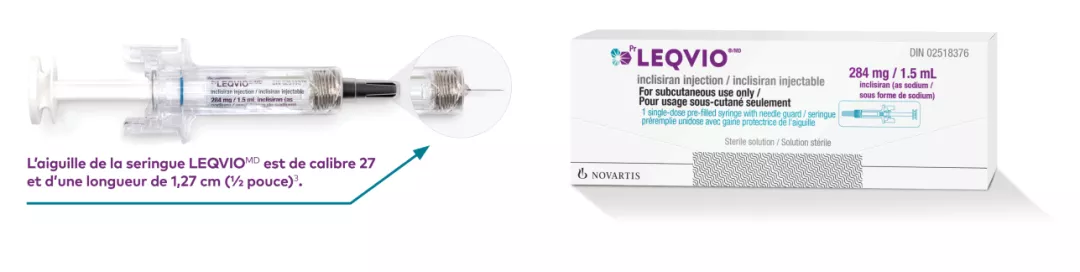
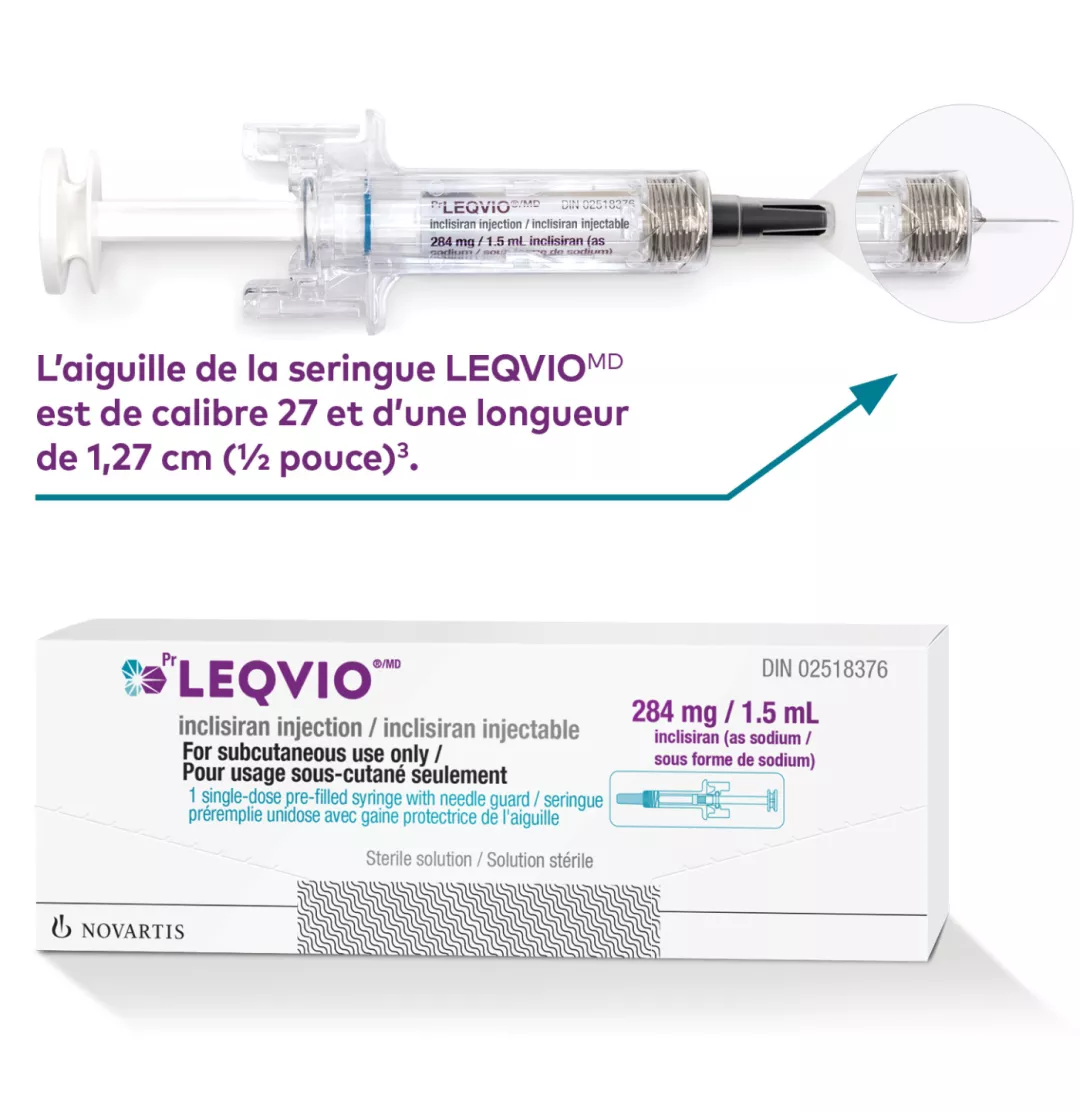
Renseignements sur le produit
Caractéristiques de la seringue1
LEQVIOMD doit être administré par un professionnel de la santé (p. ex. médecin, infirmière ou pharmacien).
pARNi = petit acide ribonucléique interférent; PCSK9 = proprotéine convertase subtilisine/kexine de type 9.
§ Vérifiez toujours la date de péremption qui figure sur la seringue préremplie avant d’administrer LEQVIOMD.
Références
1. Monographie de LEQVIOMD. Novartis Pharma Canada inc.
2. Données internes. First siRNA PCSK9i. Novartis Pharma inc., 2023.
3. Données internes. Needle Size. Novartis Pharma inc., 2023.
LEQVIOMD est une marque déposée.
© Novartis Pharma Canada inc.
Février/2025 - 425307F

Contenu connexe
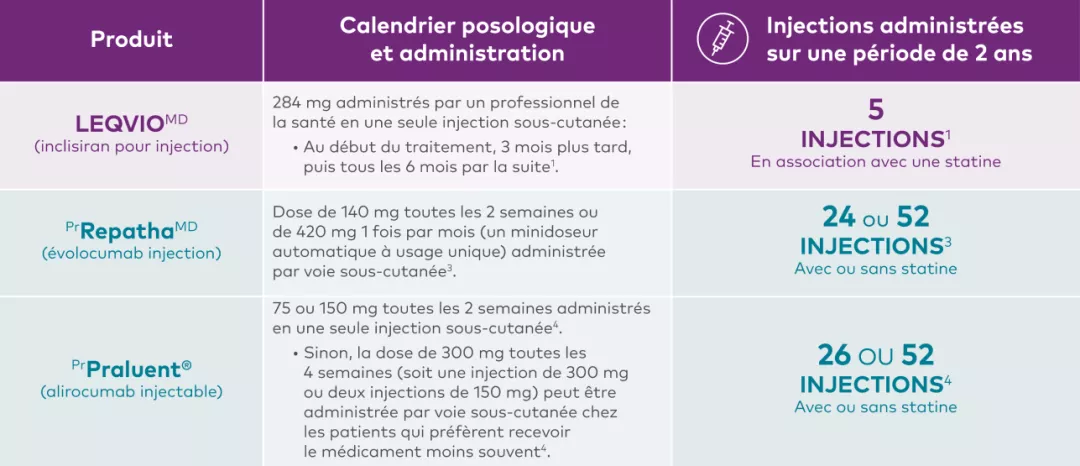
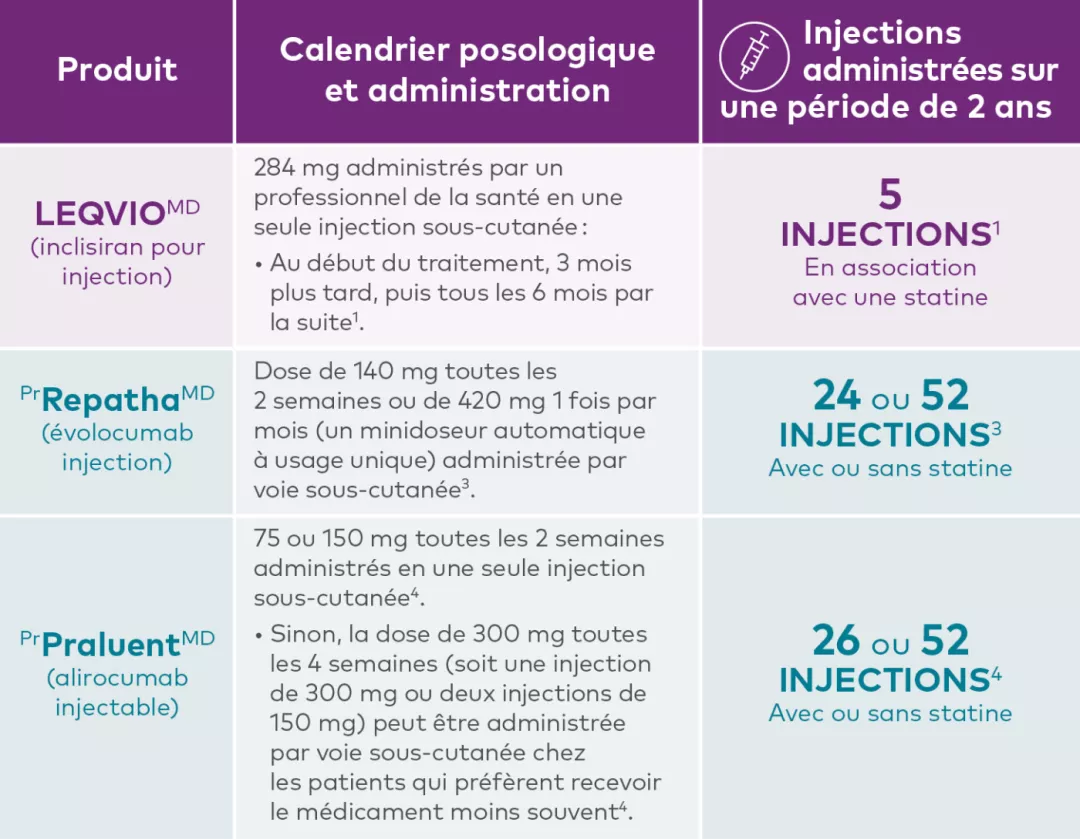
Schémas posologiques pour les inhibiteurs de la PCSK91,3,4†‡
Produit | Calendrier posologique et administration |
LEQVIOMD | 284 mg administrés par un professionnel de la santé en une seule injection sous-cutanée : |
LEQVIOMD est indiqué chez l’adulte en complément de changements des habitudes de vie, notamment le régime alimentaire, afin de réduire davantage le taux de cholestérol des lipoprotéines de basse densité (C-LDL) chez les personnes présentant l’une ou l’autre des affections suivantes et prenant la dose maximale tolérée d’une statine, avec ou sans autre traitement de réduction du taux de C-LDL : L’effet de LEQVIOMD sur la morbidité et la mortalité cardiovasculaires n’a pas été établi. | |
PrRepathaMD | Dose de 140 mg toutes les 2 semaines ou de 420 mg 1 fois par mois (un minidoseur automatique à usage unique) administrée par voie sous-cutanée.3 |
Prévention des événements : RepathaMD est indiqué comme traitement d’appoint au régime alimentaire et au traitement de référence (y compris au traitement d’intensité modérée ou élevée par une statine, seule ou en association avec un autre traitement hypolipidémiant) pour réduire le risque d’infarctus du myocarde, d’accident vasculaire cérébral ou de revascularisation coronarienne chez les patients adultes atteints d’une maladie cardiovasculaire athéroscléreuse (MCVA) grâce à une réduction supplémentaire du taux de cholestérol des lipoprotéines de basse densité (C-LDL)3. Hyperlipidémie primaire (y compris l’hypercholestérolémie familiale hétérozygote [HFHe] : RepathaMD est indiqué pour réduire le taux élevé de C-LDL chez les patients adultes atteints d’hyperlipidémie primaire (y compris l’hypercholestérolémie familiale hétérozygote [HFHe])3 : Enfants atteints d’hypercholestérolémie familiale hétérozygote : | |
PrPraluent® | 75 ou 150 mg toutes les 2 semaines administrés en une seule injection sous-cutanée4. |
Prévention des événements cardiovasculaires : Praluent® (alirocumab injectable) est indiqué en association avec une statine à la dose maximale tolérée, avec ou sans autres traitements hypolipémiants, pour réduire le risque d’infarctus du myocarde, d’accident vasculaire ischémique et d’angine instable nécessitant l’hospitalisation chez les adultes atteints d’une maladie cardiovasculaire établie4. | |
Références
1. Monographie de LEQVIOMD. Novartis Pharma Canada inc.
2. Données internes. First siRNA PCSK9i. Novartis Pharma inc., 2023.
3. Monographie de RepathaMD (injection d’évolocumab). Septembre 2023.
4. Monographie de Praluent® (alirocumab injectable). Mai 2024.
LEQVIOMD est une marque déposée.
© Novartis Pharma Canada inc.
Février/2025 - 425307F

Contenu connexe
Tableau posologique comparatif
Connaître les schémas posologiques pour les inhibiteurs de la PCSK91,3,4†‡
Obtenir ce tableau posologique comparatif pour votre clinique
Références
1. Monographie de LEQVIOMD. Novartis Pharma Canada inc.
2. Données internes. First siRNA PCSK9i. Novartis Pharma inc., 2023.
3. Monographie de RepathaMD (injection d’évolocumab). Septembre 2023.
4. Monographie de Praluent® (alirocumab injectable). Mai 2024.
LEQVIOMD est une marque déposée.
© Novartis Pharma Canada inc.
Février/2025 - 425307F