Prise en charge du C-LDL
Renseignements cliniques et ressources sur LEQVIOMD
Expérience clinique
Lignes directrices canadiennes
Hypercholestérolémie familiale (HF)
Poser un diagnostic d’hypercholestérolémie familiale hétérozygote (HFHe)
Plusieurs approches peuvent aider les cliniciens à reconnaître l’HFHe chez leurs patients, notamment:6,7
Lignes directrices 2021 de la SCC sur la dyslipidémie
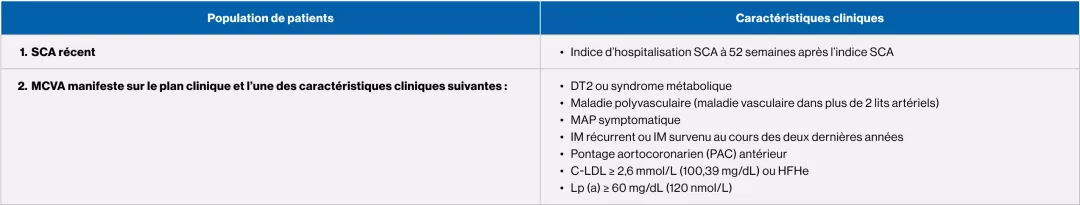
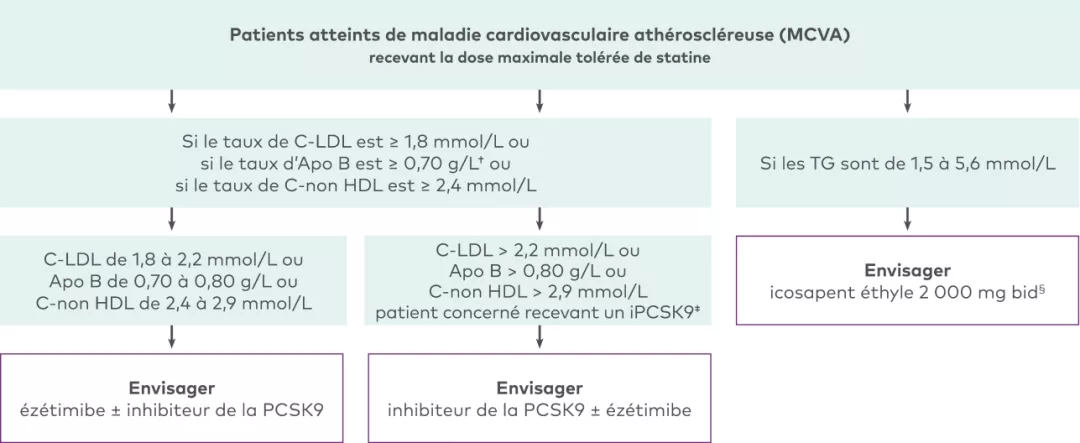
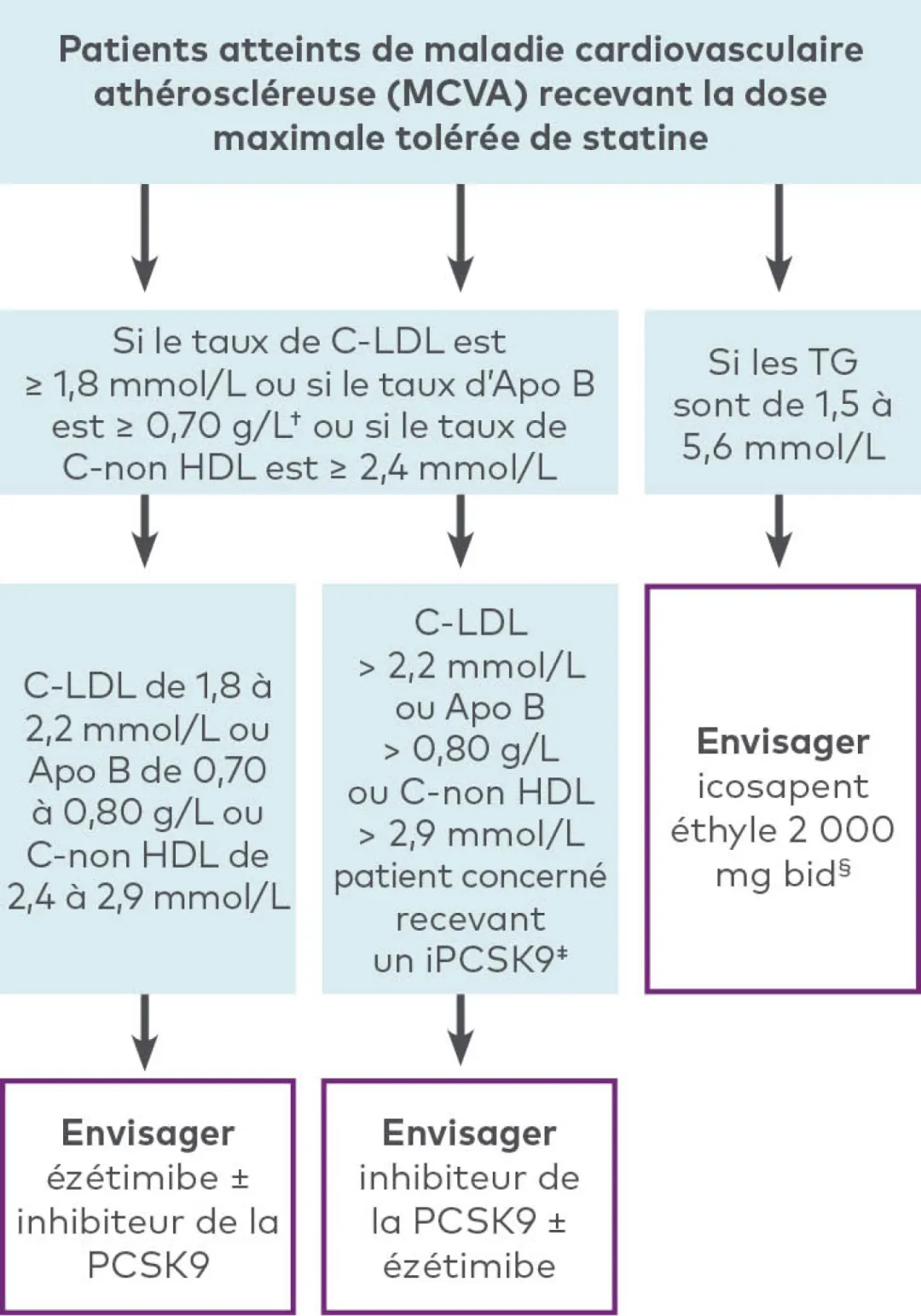
La SCC recommande d’envisager un traitement d’appoint (ézétimibe ou inhibiteur de la PCSK9) pour la prise en charge de la C-LDL chez les patients recevant la dose maximale tolérée de statine qui répondent aux critères suivants4 :
Patients atteints d’HFHe présentant un taux de C-LDL ≥ 2,5 mmol/L (ou une réduction < 50 %), un taux d’Apo B ≥ 0,85 g/L ou un taux de C-non HDL ≥ 3,2 mmol/L
Patients atteints de MCVA présentant un taux de C-LDL ≥ 1,8 mmol/L, un taux d’Apo B ≥ 0,70 g/L ou un taux de C-non HDL ≥ 2,4 mmol/L
Patients pour lesquels l’intensification du traitement hypolipidémiant par l’ajout d’un inhibiteur de la PCSK9 pourrait être indiquée4
D’après le tableau 3 des lignes directrices 2021 de la SCC sur la dyslipidémie.
Les inhibiteurs de la PCSK9 recommandés dans les lignes directrices de la SCC comprennent l’évolocumab et l’alirocumab. Les lignes directrices n’ont pas été mises à jour depuis l’autorisation de mise en marché de l’inclisiran.
Références
Monographie de LEQVIOMD. Novartis Pharma Canada inc.
Données internes. Syringe/Needle Size. Novartis Pharma inc., 2023.
Données internes. MOA. Novartis Pharma inc., 2023.
Pearson GJ, Thanassoulis G., Anderson TJ et coll. 2021 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in the Adult. Can J Cardiol. 2021;37(8):1129-1150.
Brunham LR, Ruel I., Aljenedil S. et coll. Canadian Cardiovascular Society Position Statement on Familial Hypercholesterolemia: Update 2018. Can J Cardiol. 2018;34(12):1553-1563.
Brunham LR, Ruel I., Khoury E. et coll. Familial hypercholesterolemia in Canada: Initial results from the FH Canada national registry. Atherosclerosis. 2018;277:419-424.
Ruel I., Brisson D., Aljenedil S. et coll. Simplified Canadian Definition for Familial Hypercholesterolemia. Can J Cardiol. 2018;34(9):1210-1214.
LEQVIOMD est une marque déposée.
© Novartis Pharma Canada inc.
Février/2025 - 425307F